Hatóanyagok: Montelukast
AIRING 4 mg rágótabletta
A kiszellőztető csomagbetétek a következő csomagolási méretekhez kaphatók:- AIRING 4 mg rágótabletta
- AIRING 5 mg rágótabletta
- AIRING 10 mg filmtabletta
Indikációk Miért használják a szellőzést? Mire való?
Az AIRING egy leukotrién receptor antagonista, amely blokkolja a leukotriéneknek nevezett anyagokat. A leukotriének miatt a légutak a tüdőben szűkülnek és megduzzadnak. A leukotriének blokkolásával az AIRING javítja az asztma tüneteit és segít kontrollálni.
Az orvos AIRING -et írt fel asztma kezelésére, hogy megelőzze az asztmás tüneteket nappal és éjszaka.
- Az AIRING -et olyan betegek kezelésére használják, akik nem megfelelően kontrollálják gyógyszereiket, és további gyógyszerekre van szükségük.
- Az AIRING a belélegzett kortikoszteroidok alternatív kezeléseként is alkalmazható 2-5 éves betegeknél, akik nemrégiben nem szedtek orális kortikoszteroidokat asztmára, és akikről kimutatták, hogy nem tudják használni a kortikoszteroidokat asztmára.
- Az AIRING a 2 éves és idősebb betegeknél is megakadályozza a testmozgás okozta légutak szűkülését.
Kezelőorvosa a gyermek asztmájának tüneteitől és súlyosságától függően határozza meg az AIRING alkalmazásának módját.
Mi az asztma?
Az asztma hosszú távú betegség.
Az asztma a következőket tartalmazza:
- Légzési nehézség a légutak szűkítése miatt. A légutak szűkülete rosszabbodik és javul a különböző körülményekre adott válaszként.
- A légutak, amelyek sok irritáló ingerre reagálnak, például cigarettafüstre, pollenre, hideg levegőre vagy testmozgásra.
- A légutak duzzanata (gyulladása).
Az asztma tünetei: köhögés, légszomj és mellkasi szorítás.
Ellenjavallatok a levegőztetést nem szabad használni
Ne adja le gyermekének a levegőztetést, ha allergiás (túlérzékeny) a montelukasztra vagy az AIRING egyéb összetevőjére (lásd 6. TOVÁBBI INFORMÁCIÓK).
Az alkalmazással kapcsolatos óvintézkedések Mit kell tudnia az Airing alkalmazása előtt
Tájékoztassa kezelőorvosát minden jelenlegi vagy korábbi betegségéről és bármilyen allergiáról.
Az AIRING fokozott elővigyázatossággal alkalmazható
- ha asztmája vagy légzése rosszabbodik, azonnal forduljon orvosához.
- A szájon át történő levegőztetést nem szabad akut asztmás rohamok kezelésére használni.Ha görcsök jelentkeznek, kövesse orvosa utasításait. Mindig tartsa magánál gyermeke asztmás rohamok sürgősségi belélegzett gyógyszereit.
- Fontos, hogy gyermeke minden, az orvos által előírt asztmás gyógyszert szedjen. Az AIRING -et nem szabad más asztmás gyógyszerek helyett alkalmazni, amelyeket orvosa a gyermekének írt fel.
- Ha gyermeke asztmaellenes gyógyszereket szed, tudnia kell, hogy ha olyan tünetek kombinációját tapasztalja, mint az influenzaszerű szindróma, bizsergés vagy csökkent érintés a karokban vagy a lábakban, a tüdő tüneteinek súlyosbodása és / vagy a bőrpír a bőrön, forduljon orvoshoz.
- Ne szedjen acetilszalicilsavat (aszpirint) vagy gyulladáscsökkentő gyógyszereket (más néven nem szteroid gyulladáscsökkentők vagy NSAID-ok), ha súlyosbítják az asztmát.
Alkalmazása gyermekeknél
2-5 éves gyermekek számára AIRING 4 mg rágótabletta kapható.
6-14 éves gyermekek számára AIRING 5 mg rágótabletta kapható.
Kölcsönhatások Mely gyógyszerek vagy élelmiszerek módosíthatják a szellőztetés hatását
Egyes gyógyszerek befolyásolhatják az AIRING működését, vagy az AIRING befolyásolhatja más gyógyszerek működését.
Tájékoztassa kezelőorvosát, ha gyermeke jelenleg vagy nemrégiben bármilyen más gyógyszert szed, beleértve a vény nélkül kapható készítményeket is.
Tájékoztassa kezelőorvosát, ha gyermeke az alábbi gyógyszereket szedi, mielőtt elkezdené AIRING:
- Fenobarbitál (epilepszia kezelésére alkalmazzák).
- Fenitoin (epilepszia kezelésére alkalmazzák).
- Rifampicin (tuberkulózis és más fertőzések kezelésére használják).
Az AIRING egyidejű alkalmazása étellel és itallal
Az AIRING 4 mg rágótablettát nem szabad közvetlenül étkezés előtt vagy után bevenni. Ezt legalább 1 órával étkezés előtt vagy 2 órával étkezés után kell bevenni.
Figyelmeztetések Fontos tudni, hogy:
Terhesség és szoptatás
Ez a szakasz nem alkalmazható, mert az AIRING 4 mg rágótabletta 2 és 5 év közötti gyermekeknél alkalmazható. Az alábbi információk azonban a montelukaszt hatóanyagra vonatkoznak.
Alkalmazása terhesség alatt
Ha terhes vagy teherbe szeretne esni, az AIRING szedése előtt konzultálnia kell orvosával. Kezelőorvosa fogja eldönteni, hogy ilyen körülmények között veheti -e be vagy nem az AIRING -et.
Használja szoptatás alatt
Nem ismert, hogy az AIRING megjelenhet -e az anyatejben. Ha szoptat vagy szoptatni tervez, az AIRING szedése előtt konzultálnia kell orvosával.
A készítmény hatásai a gépjárművezetéshez és gépek kezeléséhez szükséges képességekre
A gépjárművezetéshez és gépek kezeléséhez szükséges képességekre gyakorolt hatás nem várható.
A gyógyszerekre adott egyéni válasz azonban eltérő lehet. Bizonyos mellékhatások (például szédülés és aluszékonyság), amelyeket nagyon ritkán jelentettek az AIRING alkalmazásakor, befolyásolhatják a gépjárművezetéshez és gépek kezeléséhez szükséges képességeket.
Fontos információk az AIRING egyes összetevőiről
Az AIRING rágótabletta aszpartámot, fenilalanin forrást tartalmaz. Ha gyermeke fenilketonuriában (ritka, örökletes anyagcserezavarban) szenved, kérjük, vegye figyelembe, hogy a 4 mg -os rágótabletta tablettánként 0,674 mg fenilalaninnal egyenértékű fenilalanint tartalmaz.
Adagolás, az alkalmazás módja és ideje A szellőztetés használata: Adagolás
- Ezt a gyógyszert felnőtt felügyelete mellett kell adni a gyermeknek.
- A gyermek naponta csak egy AIRING tablettát vegyen be, az orvos előírása szerint.
- A tablettát akkor is be kell venni, ha gyermekének nincsenek tünetei vagy akut asztmás rohama van.
- Az AIRING -t mindig az orvos által elmondottaknak megfelelően szedje. Ha kétségei vannak, forduljon orvosához vagy gyógyszerészéhez.
- A tablettát szájon át kell bevenni.
2-5 éves gyermekek számára
Egy 4 mg -os rágótabletta minden nap este. Az AIRING 4 mg rágótablettát nem szabad közvetlenül étkezés előtt vagy után bevenni. Ezt legalább 1 órával étkezés előtt vagy 2 órával étkezés után kell bevenni.
Ha gyermeke AIRING -et szed, ügyeljen arra, hogy ne vegyen be más, ugyanazt a hatóanyagot, a montelukasztot tartalmazó készítményeket.
Ha elfelejtette levegőztetni gyermekét
Próbálja meg úgy venni az AIRING -et, ahogy előírták. Ha azonban elfelejtett bevenni egy tablettát, folytassa a gyógyszer szedését a szokásos adaggal. Ne adjon kétszeres adagot a kihagyott tabletta pótlására.
Ha gyermeke abbahagyja az AIRING szedését
Az AIRING -kezelés csak akkor lehet hatásos az asztma ellen, ha gyermeke továbbra is szedni kell. Ez segít a baba asztmájának ellenőrzésében.
Ha bármilyen további kérdése van az AIRING alkalmazásával kapcsolatban, kérdezze meg kezelőorvosát vagy gyógyszerészét.
Túladagolás Mi a teendő, ha túl sok levegőt vett be?
Azonnal forduljon orvosához. A túladagolási jelentések többségében nem voltak nemkívánatos hatások. A felnőttek és gyermekek túladagolásakor leggyakrabban jelentett tünetek közé tartozik a hasi fájdalom, álmosság, szomjúság, fejfájás, hányás és hiperaktivitás.
Mellékhatások Melyek a szellőztetés mellékhatásai
Mint minden gyógyszer, így az AIRING is okozhat mellékhatásokat, amelyek azonban nem mindenkinél jelentkeznek.
A 4 mg -os montelukaszt rágótablettával végzett klinikai vizsgálatokban a leggyakrabban jelentett mellékhatások, amelyek feltételezetten a montelukaszthoz kapcsolódnak (100 beteg közül legalább 1 -nél és 10 kezelt gyermekbetegről kevesebb mint 1 -nél fordultak elő):
- hasi fájdalom
- szomjúság
Ezenkívül a következő mellékhatásokat jelentették a montelukaszt 10 mg filmtablettával és 5 mg rágótablettával végzett klinikai vizsgálatok során:
- fejfájás
Ezek a mellékhatások általában enyhék voltak, és gyakrabban fordultak elő a montelukasztgal kezelt betegeknél, mint a placebóval (tabletta, amely nem tartalmaz hatóanyagot).
A lehetséges mellékhatások gyakoriságát az alábbiakban felsorolva határozzuk meg:
- Nagyon gyakori (10 beteg közül legalább 1 -et érint)
- Gyakori (100 -ból 1-10 beteget érint)
- Nem gyakori (1000 -ből 1-10 beteget érint)
- Ritka (10 000 -ből 1-10 beteget érint)
- Nagyon ritka (10 000 -ből kevesebb, mint 1 beteget érint)
Ezenkívül az alábbi mellékhatásokat jelentették a gyógyszer kereskedelmi használata során:
- felső légúti fertőzés (nagyon gyakori)
- fokozott vérzési hajlam (ritka)
- allergiás reakciók, beleértve a bőrkiütést, az arc, az ajkak, a nyelv és / vagy a torok duzzanatát, amely légzési vagy nyelési nehézséget okozhat (nem gyakori)
- viselkedés- és hangulatváltozások [megváltozott álmok, beleértve a rémálmokat, álmatlanságot, alvajárást, ingerlékenységet, szorongást, nyugtalanságot, izgatottságot, beleértve az agresszív viselkedést vagy ellenségeskedést, depressziót (nem gyakori); remegést (ritka); hallucinációkat, gondolatokat és cselekedeteket öngyilkosság (nagyon ritka) ]
- szédülés, aluszékonyság, bizsergés, görcsök (nem gyakori)
- szívdobogás (ritka)
- orrvérzés (nem gyakori)
- hasmenés, hányinger, hányás (gyakori); szájszárazság, emésztési zavarok (nem gyakori)
- hepatitis (májgyulladás) (nagyon ritka)
- véraláfutás, viszketés, csalánkiütés (nem gyakori), a bőr alatti szövet vörös, fájdalmas duzzanata, leggyakrabban a lábak elülső felületén (eritéma nodosum) (nagyon ritka)
- ízületi vagy izomfájdalom, izomgörcsök (nem gyakori)
- láz (gyakori); fáradtság, rosszullét, duzzanat (nem gyakori)
Nagyon ritka esetekben olyan tünetek összességéről számoltak be, mint az influenzaszerű forma, bizsergés vagy zsibbadás a karokban vagy a lábakban, a tüdőtünetek súlyosbodása és / vagy bőrkiütés a montelukaszt. Asztmás betegek kezelése során. Churg-Strauss) . Ha egy vagy több ilyen tünet jelentkezik, a betegnek abba kell hagynia a gyógyszer szedését, és azonnal forduljon orvosához.
A mellékhatásokról további információért forduljon orvosához vagy gyógyszerészéhez. Tájékoztassa kezelőorvosát vagy gyógyszerészét a fent felsoroltaktól eltérő mellékhatásokról, vagy ha a tünetek továbbra is fennállnak vagy súlyosbodnak.
Mellékhatások bejelentése
Ha Önnél bármilyen mellékhatás jelentkezik, tájékoztassa erről kezelőorvosát vagy gyógyszerészét. Ez a betegtájékoztatóban fel nem sorolt bármilyen lehetséges mellékhatásra is vonatkozik. A mellékhatásokat közvetlenül a hatóság részére is bejelentheti az V. függelékben található elérhetőségeken keresztül. A mellékhatások bejelentésével Ön is hozzájárulhat ahhoz, hogy minél több információ álljon rendelkezésre a gyógyszer biztonságosságáról.
Lejárat és megőrzés
Az AIRING -et gyermekek elől elzárva tartandó!
Ne használja az AIRING -et a címkén feltüntetett lejárati idő után, az EXP szó utáni hat számmal. Az első két szám a hónapot jelöli; A lejárati idő a hónap utolsó napjára vonatkozik.
A fénytől és nedvességtől való védelem érdekében az eredeti csomagolásban legfeljebb 25 ° C -on tárolandó.
A gyógyszereket nem szabad a szennyvízzel vagy a háztartási hulladékkal együtt megsemmisíteni. Kérdezze meg gyógyszerészét, hogy mit tegyen a már nem használt gyógyszereivel. Ez segít a környezet védelmében.
Egyéb információk
Mit tartalmaz az AIRING?
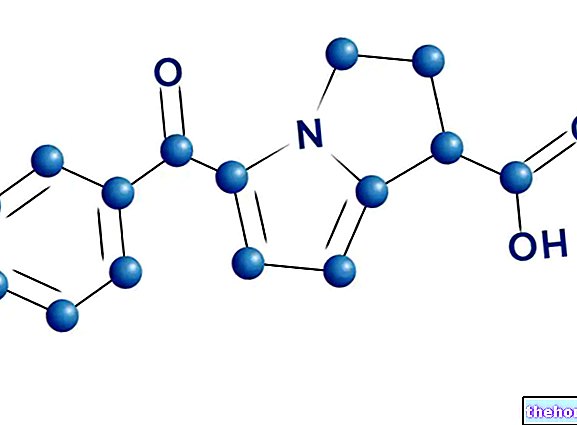
- A készítmény hatóanyaga a montelukaszt. Minden tabletta montelukaszt -nátriumot tartalmaz, amely 4 mg montelukasztnak felel meg.
- Egyéb összetevők: mannit (E421), mikrokristályos cellulóz, kroszkarmellóz -nátrium, vörös vas -oxid (E172), hidroxipropil -cellulóz, cseresznye aroma (glicerin -triacetátot (E1518) is tartalmaz), aszpartám (E951) és magnézium -sztearát.
A SZELLŐZÉS megjelenésének leírása és a csomag tartalma
28 tabletta doboz: 4 buborékcsomagolás, egyenként 7 tablettával.
Forrás betegtájékoztató: AIFA (Olasz Gyógyszerügynökség). A tartalom 2016 januárjában jelent meg. A jelenlévő információk nem feltétlenül naprakészek.
A legfrissebb verzióhoz való hozzáféréshez ajánlatos az AIFA (Olasz Gyógyszerügynökség) webhelyét elérni. Jogi nyilatkozat és hasznos információk.
01.0 A GYÓGYSZER MEGNEVEZÉSE
SZELLŐZÉS 4 MG
02.0 MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL
Egy rágótabletta tartalmaz:
Hatóanyag: montelukaszt -nátrium, ami 4 mg montelukasztnak felel meg.
Segédanyag: 1,2 mg aszpartám (E951) tablettánként.
A segédanyagok teljes listáját lásd a "Segédanyagok listája" részben.
03.0 GYÓGYSZERFORMA
Rágótabletta.
Rózsaszín, lekerekített, domború, 8,5 mm átmérőjű, egyik oldalán "4" jelzéssel.
04.0 KLINIKAI INFORMÁCIÓK
04.1 Terápiás javallatok
Az AIRING asztma kezelésére javallt kiegészítő terápiaként azoknál a betegeknél, akik tartósan enyhe / közepesen súlyos asztmában szenvednek, és akiket nem lehet megfelelően szabályozni inhalációs kortikoszteroidokkal, és akiknél a rövid hatású „szükséglet” nem biztosítja az asztma megfelelő klinikai kontrollját.
Az AIRING alternatív kezelési lehetőség lehet az alacsony dózisú inhalációs kortikoszteroidok kezelésére is 2-5 éves, enyhe, tartós asztmában szenvedő betegeknél, akiknek a közelmúltban nem voltak súlyos asztmás rohamai, amelyek orális kortikoszteroidok alkalmazását igényelték, és akikről kimutatták, hogy ne használjon inhalációs kortikoszteroidokat (lásd "Adagolás és alkalmazás" fejezet).
Az AIRING az asztma megelőzésére is ajánlott 2 éves kortól, ahol az uralkodó komponens a terhelés okozta hörgőszűkület.
04.2 Adagolás és alkalmazás
Ezt a gyógyszert felnőtt felügyelete mellett kell adni a gyermeknek. A 2-5 éves gyermekgyógyászati betegek adagja napi egy 4 mg -os rágótabletta, este. Étkezés közben bevéve az AIRING -et vagy egy órával az étkezés előtt, vagy két órával azután kell bevenni. Ebben a korcsoportban nincs szükség dózismódosításra. A 4 mg -os rágótabletta -készítmény nem ajánlott 2 év alatti gyermekek számára.
Általános ajánlások. Az AIRING terápiás hatása az asztma kontroll paramétereire egy napon belül nyilvánvalóvá válik. Tanácsolja a beteget, hogy folytassa az AIRING szedését akkor is, ha az asztma kontroll alatt van, valamint az asztma súlyosbodásának időszakában.
Veseelégtelenségben vagy enyhe vagy közepesen súlyos májkárosodásban szenvedő betegeknél nincs szükség az adag módosítására. Nincsenek adatok súlyos májkárosodásban szenvedő betegekről. Az adagolás mindkét nemben ugyanaz.
SZELLŐZTETÉS az alacsony dózisú inhalációs kortikoszteroidok alternatív kezelési lehetőségeként tartós enyhe asztma esetén:
A montelukaszt alkalmazása nem javasolt monoterápiaként mérsékelten perzisztáló asztmában szenvedő betegeknél. A montelukaszt alternatív kezelési lehetőségként történő alkalmazása az alacsony dózisú inhalációs kortikoszteroidokhoz enyhe, tartós asztmában szenvedő gyermekeknél csak akkor vehető figyelembe. a közelmúltban súlyos asztmás rohamok esetén, amelyek szájon át szedhető kortikoszteroidokat igényelnek, és akikről kimutatták, hogy nem tudják használni az inhalációs kortikoszteroidokat (lásd "Terápiás javallatok"). A tartósan enyhe asztmát úgy határozzák meg, mint az asztmás tüneteket, amelyek hetente többször fordulnak elő, de naponta ritkábban, és az éjszakai tüneteket, amelyek havonta kétszer, de hetente ritkábban fordulnak elő. Az epizódok közötti tüdőfunkció normális. Ha a követés során (általában egy hónapon belül) nem sikerül kielégíteni az asztma kezelését, akkor az asztma fokozatos kezelési megközelítése alapján meg kell fontolni a kiegészítő vagy eltérő gyulladáscsökkentő kezelés szükségességét. .
LÉGZÉS az asztma megelőzésére 2 és 5 év közötti betegeknél, amelyekben a túlsúlyos összetevő a testmozgás által kiváltott hörgőszűkület :
2-5 éves betegeknél a testmozgás által kiváltott hörgőszűkület lehet az inhalációs kortikoszteroidokkal való kezelést igénylő tartós asztma túlnyomó megnyilvánulása. A betegeket 2-4 hetes kezelés után értékelni kell. Montelukaszt-kezelés vagy más terápiát kell mérlegelni.
AIRING terápia az asztma egyéb kezeléseihez képest:
Ha az AIRING kezelést az inhalációs kortikoszteroidok kiegészítő terápiájaként alkalmazzák, az AIRING nem helyettesíthető hirtelen az inhalációs kortikoszteroidokkal (lásd "Különleges figyelmeztetések és az alkalmazással kapcsolatos óvintézkedések" című részt).
10 mg filmtabletta felnőttek és 15 éves és idősebb serdülők számára kapható.
5 mg rágótabletta kapható 6 és 14 év közötti betegek számára.
Az alkalmazás módja
A tablettát rágni kell.
04.3 Ellenjavallatok
A készítmény hatóanyagával vagy bármely segédanyagával szembeni túlérzékenység.
04.4 Különleges figyelmeztetések és a használathoz szükséges óvintézkedések
Tájékoztassa a beteget, hogy ne alkalmazza az orális montelukasztot akut asztmás rohamok kezelésére, és tartson kéznél megfelelő sürgősségi gyógyszereket. Akut roham esetén inhalációs? -Adrenerg agonistát kell alkalmazni. Abban az esetben, ha a betegnek a szokásosnál több inhalációs agonista? -Adrenergára van szüksége, a lehető leghamarabb lépjen kapcsolatba a kezelőorvossal.
A montelukaszt nem helyettesíthető hirtelen inhalációs vagy orális kortikoszteroidokkal.
Nincs adat arra vonatkozóan, hogy a kortikoszteroidok orális adagja csökkenthető a montelukaszt egyidejű alkalmazásával.
Ritka esetekben az asztmaellenes gyógyszereket, köztük a montelukasztot szedő betegeknél szisztémás eozinofília léphet fel, amely néha a vaszkulitisz klinikai jellemzőiként nyilvánul meg, hasonlóan a Churg-Strauss-szindrómához, amelyet gyakran terápiával kezelnek. Ezeket az eseteket általában, de nem mindig, az orális kortikoszteroid -kezelés csökkentésével vagy abbahagyásával hozták összefüggésbe.
Nem zárható ki vagy állapítható meg annak a lehetősége, hogy a leukotrién receptor antagonisták összefüggésben lehetnek a Churg-Strauss-szindróma kialakulásával. Az orvosoknak figyelemmel kell kísérniük a betegeket eozinofília, vaszkulitisz kiütés, súlyosbodó tüdőtünetek, szívbetegségek és / vagy neuropátia tekintetében. Azokat a betegeket, akiknél ezek a tünetek jelentkeznek, értékelni kell, és át kell gondolni a kezelési rendjüket.
A 4 mg -os rágótabletta biztonságosságát és hatásosságát 2 év alatti gyermekek körében nem igazolták. Ezért használatuk 2 éves kor alatt nem ajánlott.
Az AIRING aszpartámot, fenilalanin forrást tartalmaz. A fenilketonuriában szenvedő betegeknek figyelembe kell venniük, hogy minden 4 mg -os rágótabletta adagonként 0,674 mg -nak megfelelő mennyiségben tartalmaz fenilalanint.
04.5 Kölcsönhatások más gyógyszerekkel és egyéb interakciók
A montelukaszt más, az asztma megelőzésében és krónikus kezelésében gyakran használt gyógyszerekkel együtt is alkalmazható. A gyógyszerkölcsönhatási vizsgálatokban a montelukaszt ajánlott klinikai dózisa nem volt klinikailag jelentős hatással a következő gyógyszerek farmakokinetikájára: teofillin, prednizon, prednizolon, fogamzásgátlók orális (etinilösztradiol / noretindron 35/1), terfenadin, digoxin és warfarin.
A montelukaszt plazmakoncentrációs görbéje alatti terület (AUC) körülbelül 40% -kal csökkent azoknál az alanyoknál, akiket egyidejűleg adtak be fenobarbitállal. 3A4, például fenitoin, fenobarbitál és rifampicin.
In vitro vizsgálatok kimutatták, hogy a montelukaszt erős CYP2C8 inhibitor. Mindazonáltal a montelukaszt és a roziglitazon (egy szubsztrát, amelyet elsősorban a CYP2C8 által metabolizált gyógyszerek reprezentatív tesztjeként használtak) klinikai gyógyszerkölcsönhatási vizsgálatának adatai azt mutatták, hogy a montelukaszt nem gátolja a CYP2C8 in vivo. A montelukaszt ezért várhatóan nem fogja jelentősen megváltoztatni az ezen enzim által metabolizált gyógyszerek (pl. Paklitaxel, roziglitazon és repaglinid) metabolizmusát.
04.6 Terhesség és szoptatás
Terhesség alatt alkalmazza
Állatkísérletek nem mutatják ki a terhességre vagy az embrionális -magzati fejlődésre gyakorolt káros hatások jelenlétét.
A terhességi adatbázisokban rendelkezésre álló korlátozott adatok nem utalnak ok-okozati összefüggés fennállására az AIRING és a világszerte forgalomba hozatalt követően ritkán jelentett rendellenességek (végtaghibák) között.
Az AIRING csak akkor alkalmazható terhesség alatt, ha egyértelműen elengedhetetlennek tartja.
Használja szoptatás alatt
Patkányokon végzett vizsgálatok kimutatták, hogy a montelukaszt kiválasztódik az anyatejbe (lásd "Preklinikai biztonságossági adatok"). Nem ismert, hogy a montelukaszt kiválasztódik -e a szoptató nők anyatejébe.
Az AIRING csak akkor alkalmazható szoptatás alatt, ha egyértelműen elengedhetetlennek tartja.
04.7 Hatások a gépjárművezetéshez és gépek kezeléséhez szükséges képességekre
Úgy gondolják, hogy a montelukaszt nem befolyásolja a gépjárművezetéshez és gépek kezeléséhez szükséges képességeket, de nagyon ritka esetekben egyesek álmosságról vagy szédülésről számoltak be.
04.8 Nemkívánatos hatások
A montelukasztot a következő klinikai vizsgálatokban értékelték:
• 10 mg filmtabletta körülbelül 4000 felnőtt, ≥ 15 éves betegnél
• 5 mg rágótabletta körülbelül 1750 6-14 éves gyermekgyógyászati betegnél
• 4 mg rágótabletta 851 2-5 éves gyermekgyógyászati betegnél.
A következő, gyógyszerrel kapcsolatos mellékhatásokat jelentették gyakran (> 1/100, placebo):
A klinikai vizsgálatokban folytatott terápia során, legfeljebb 2 évig, korlátozott számú felnőtt betegnél és legfeljebb 12 hónapig 6–14 éves gyermekgyógyászati betegeknél, a biztonsági profil nem változott.
Összességében 502 2-5 éves gyermekbeteget kezeltek montelukasztgal legalább 3 hónapig, 338 beteget 6 hónapig vagy tovább, és 534 beteget 12 hónapig vagy tovább. Hosszú kezelés esetén a biztonsági profil még ezeknél a betegeknél sem változott.
Marketing utáni tapasztalat
A forgalomba hozatalt követően jelentett mellékhatások az alábbi táblázatban vannak felsorolva, szervrendszeri osztály és a mellékhatások sajátos terminológiája alapján. A gyakorisági kategóriákat releváns klinikai vizsgálatok alapján becsülték meg.
04.9 Túladagolás
Nincs specifikus információ a montelukaszt túladagolásának kezeléséről. A krónikus asztmás vizsgálatokban a montelukasztot felnőtt betegeknek adták napi 200 mg-os dózisban 22 héten keresztül, rövid távú vizsgálatokban pedig legfeljebb 900 mg-ig körülbelül egy hétig, klinikailag fontos mellékhatások nélkül.
A forgalomba hozatalt követően és a montelukaszt klinikai vizsgálatai során akut túladagolásról számoltak be. Ezek közé tartoznak a felnőttek és gyermekek 1000 mg-os dózisig (kb. 61 mg / kg 42 hónapos gyermeknél) történő bejelentései. Megfigyelt laboratóriumi eredmények összhangban van a biztonságossági profillal felnőtteknél és gyermekgyógyászati betegeknél. A túladagolási esetek többségében nem voltak káros tapasztalatok. A leggyakrabban megfigyelt mellékhatások összhangban voltak a montelukaszt biztonságossági profiljával, beleértve a hasi fájdalmat, aluszékonyságot, szomjúságot, fejfájást, hányást és pszichomotoros hiperaktivitás.
Nem ismert, hogy a montelukaszt dializálható -e peritoneális vagy hemodialízissel.
05.0 FARMAKOLÓGIAI TULAJDONSÁGOK
05.1 Farmakodinámiás tulajdonságok
Farmakoterápiás csoport: egyéb szisztémás gyógyszerek obstruktív légúti betegségek kezelésére. Leukotrién receptor antagonisták.
ATC kód: R03D C03.
A ciszteinil-leukotriének (LTC4, LTD4, LTE4) erős gyulladásos eikozanoidok, amelyeket különböző sejtek, köztük hízósejtek és eozinofilek bocsátanak ki. Ezek a fontos asztma-mediátorok a ciszteinil-leukotrién-receptorokhoz (CysLT) kötődnek, amelyek emberekben a légutakban találhatók, és különböző hatásokat okoznak a légutakban, beleértve a hörgőszűkületet, a nyálkahártya-szekréciót, az erek permeabilitását és az eozinofil-toborzást.
A montelukaszt orálisan aktív vegyület, amely nagy affinitással és szelektivitással kötődik a CysLT1 receptorhoz. Klinikai vizsgálatokban a montelukaszt alacsony dózisban, például 5 mg-ban gátolja az LTD4 belégzése által okozott hörgő-összehúzódást. Az orális beadást követő két órán belül bronchodilatációt figyeltek meg. A béta-adrenerg agonista által kiváltott hörgőtágító hatás kiegészítette a montelukaszt. A montelukaszt -kezelés gátolta az antigén „expozíciója” által okozott hörgőszűkület korai és késői szakaszát is. A montelukaszt a placebóhoz képest csökkentette a perifériás vér eozinofiljeit mind felnőtt, mind gyermekgyógyászati betegeknél. Egy külön vizsgálatban a montelukaszt -kezelés jelentősen csökkentette a légúti eozinofileket („köpetvizsgálat” eredményeként). 2–14 éves felnőtt és gyermekgyógyászati betegeknél a montelukaszt a placebóhoz képest csökkentette a perifériás vér eozinofileit, miközben javította az asztma klinikai kontrollját.
A felnőttek és a placebó elleni vizsgálatokban a napi egyszeri 10 mg montelukaszt kimutatta, hogy jelentősen javítja a reggeli FEV1 -et (a kiindulási értékhez viszonyított változások 10,4% vs 2,7%), a reggeli csúcskiáramlás (PEFR) (a kiindulási értékhez képest 24,5 l / perc 3,3 l / perc), és jelentősen csökkenti az α -adrenerg agonisták teljes használatát (a kiindulási értékhez képest változás -26,1% vs -4,6%).
Felnőtt vizsgálatokban a montelukasztról kimutatták, hogy additív klinikai hatást fejt ki az inhalációs kortikoszteroid által kiváltotthoz (százalékos változások a kiindulási értékhez képest a belélegzett beklometazon plusz montelukaszt és a beklometazon között a FEV1 -ben: 5,43% vs 104% és a -adrenerg agonisták alkalmazása : -8,70% vs 2,64%). A montelukasztra adott kezdeti válasz gyorsabb volt, mint a belélegzett beklometazon (200 mcg naponta kétszer, távtartó eszközön keresztül), bár a beklometazon nagyobb átlagos hatást biztosított a tizenkét hetes vizsgálati időszak alatt (százalékos változások a kiindulási értékhez képest a montelukaszthoz képest a beklometazonhoz képest a FEV1 -ben: 7,49% vs 13,3% és a -adrenerg agonisták alkalmazása: -28,28% vs -43,89%). Azonban a montelukasztgal kezelt betegek nagy százaléka hasonló klinikai választ ért el, mint a beklometazon esetében (pl. A beklometazonnal kezelt betegek 50% -ánál a FEV1 javulása megközelítőleg 11% vagy több volt, mint a kiindulási érték, míg körülbelül 42% a montelukasztgal kezelt betegeknél ugyanaz a válasz).
Egy 12 hetes, placebo-kontrollos vizsgálatban, 2-5 éves gyermekeknél, napi egyszer 4 mg montelukaszt javította az asztma kontroll paramétereit a placebóhoz képest, függetlenül a kontroll terápiák (inhalált / porlasztott kortikoszteroidok vagy inhalált / porlasztott nátrium-kromoglikát) egyidejű alkalmazásától. . A betegek hatvan százalékát nem kezelték más kontroll terápiákkal. A montelukaszt a placebóhoz képest javította a nappali tüneteket (beleértve a köhögést, ziháló légzést, légzési nehézséget és korlátozott motoros aktivitást) és az éjszakai tüneteket. A montelukaszt-kezelésben részesülő betegek több napig asztmától mentesek voltak, mint azok, akik placebót kaptak. A kezelés az első adag után eredményt hozott.
Egy 12 hónapos, placebo-kontrollos vizsgálatban 2-5 éves, enyhe asztmás és epizodikus exacerbációjú gyermekgyógyászati betegeknél a 4 mg montelukaszt naponta egyszer szignifikánsan (p <0,001) csökkentette az exacerbációk (EE) éves gyakoriságát a placebóhoz képest (1,60 EE vs 2,34 EE, ill. 95% -os CI -val 16,9, 44,1.
Egy 8 hetes, 6-14 éves gyermekeknél végzett vizsgálatban a montelukaszt naponta egyszer 5 mg-mal a placebóval összehasonlítva jelentősen javította a légzési funkciót (a FEV1 kiindulási értékhez képest 8,71% vs 4,16%; változás a kiindulási értékhez képest AM PEFR 27,9 l / perc vs 17,8 l / perc), és szükség szerint csökkentette a "p -antagonisták használatát" (változás a kiindulási értékhez képest -11,7% vs + 8,2%).
Egy 12 hónapos összehasonlító vizsgálatban, amely a montelukaszt és az inhalációs flutikazon asztmás kontrollra gyakorolt hatékonyságát mutatta ki 6-14 éves, tartósan enyhe asztmában szenvedő gyermekgyógyászati betegeknél, a montelukaszt nem volt rosszabb a flutikazonhoz képest, mivel növelte a napok százalékos arányát mentő kezelés nélkül ( RFD), az elsődleges végpont. Az RFD átlagos százaléka a 12 hónapos kezelési időszak alatt 61,6-ról 84,0-ra emelkedett a montelukaszt csoportban és 60,9-ről 86,7-re a flutikazon-csoportban. A legkisebb négyzetek (LS) csoportjai közötti különbség az RFD százalékos növekedése statisztikailag szignifikáns volt (-2,8, 95% -os CI -4,7, -0,9) Kilátás.
Mind a montelukaszt, mind a flutikazon javította az asztma kontrollját a 12 hónapos kezelési időszak során értékelt másodlagos változók esetén: a VEF1 a montelukaszt-csoportban 1,83-ról 2,09-re, a flutikazon-csoportban 1,85-ről 2,14-re emelkedett. Az LS átlagos növekedése A FEV1 a csoportok között -0,02 l volt, 95% -os CI -0,06, 0,02. A FEV1 várható százalékában a növekedés a kiindulási értékhez képest 0,6% volt a montelukaszt -kezelési csoportban, és 2,7% a flutikazon -csoportban. 95% CI -3,6, -0,7. A β -agonistákat használó napok százalékos aránya 38,0 -ről 15,4 -re csökkent a montelukaszt -csoportban, és 38,5 -ről 12,8 -ra a flutikazon -csoportban. A csoportok közötti különbség a napok százalékos LS átlagában a β-agonisták alkalmazása 2,7 volt, 95% -os CI 0,9, 4, 5.
Az asztmás rohamban szenvedő betegek százalékos aránya (az asztma súlyosbodásának időszaka, amely szteroid kezelést igényel os, nem tervezett orvosi látogatás, sürgősségi osztálylátogatás vagy kórházi kezelés) 32,2 volt a montelukaszt csoportban és 25,6 a flutikazon csoportban; az esélyhányados (95% CI) 1,38 volt.
A vizsgálat során a szisztémás (túlnyomórészt szájon át szedett) kortikoszteroidokat szedő betegek százalékos aránya 17,8% volt a montelukaszt és 10,5% a flutikazon csoportban. A csoportok közötti LS átlagkülönbség 7,3% volt, 95% -os CI 2,9, 11,7.
A gyakorlatok által kiváltott hörgő-összehúzódás (BIE) jelentős csökkenését igazolták egy 12 hetes, felnőtteken végzett vizsgálatban (a FEV1 maximális csökkenése: 22,33% a montelukaszt esetében vs 32,40% a placebo esetében; a FEV1 helyreállítási ideje olyan értékre, amely nem tér el 5% -nál nagyobb mértékben az alapvonaltól: 44,22 perc vs 60,64 perc)
Ez a hatás következetesen megismétlődött a vizsgálat 12 hetes időtartama alatt. A BIE csökkenését egy rövid távú vizsgálatban is kimutatták 6–14 éves gyermekeknél (a FEV1 maximális csökkenése: 18,27% vs 26,11%; a FEV1 helyreállítási ideje olyan értékre, amely nem tér el 5% -nál nagyobb mértékben az alapvonaltól: 17,76 perc vs 27,98 perc). Mindkét vizsgálatban a hatást a napi egyszeri adagolási intervallum végén mutatták ki.
Azoknál az aszpirinérzékeny asztmás betegeknél, akik inhalációs és / vagy orális kortikoszteroidokat kapnak egyidejűleg, a montelukaszt-kezelés a placebóhoz képest jelentős javulást eredményezett az asztmában (a FEV1 százalékos változása a kiindulási értékhez képest: 8,55% vs -1,74%; a p -adrenerg agonisták teljes használatának csökkenése a kiindulási értékhez képest: -27,78% vs 2,09%).
05.2 Farmakokinetikai tulajdonságok
Abszorpció
Orális alkalmazás után a montelukaszt gyorsan felszívódik. A 10 mg-os filmtabletta esetében a maximális plazmakoncentráció (Cmax) átlagos értéke felnőtteknél éhgyomorra történő beadás után 3 órával (Tmax) éri el. Az átlagos biohasznosulás orális alkalmazás után 64%. Orális biológiai hozzáférhetőség és Cmax nem befolyásolja az étkezés alapértelmezett. Biztonságát és hatékonyságát klinikai vizsgálatok során igazolták, ahol 10 mg filmtablettát adtak be, függetlenül az étkezési idő beosztásától.
Az 5 mg -os rágótabletta esetében a felnőttkori Cmax éhgyomorra 2 óra elteltével érhető el. Az átlagos biohasznosulás orális alkalmazás után 73%, és étkezés közben 63% -ra csökken. alapértelmezett.
A 4 mg rágótabletta éhgyomorra 2-5 éves gyermekeknek történő beadása után a Cmax 2 óra alatt érhető el. Az átlagos C nagyobb, mint 66%, míg a C min kisebb, mint a 10 mg -os tablettát szedő felnőtteké.
terjesztés
A montelukaszt több mint 99% -a plazmafehérjékhez kötődik. A montelukaszt egyensúlyi állapotú eloszlási térfogata átlagosan 8-11 liter. Patkányokon végzett, radioaktívan jelölt montelukaszttal végzett vizsgálatok azt mutatják, hogy minimális az eloszlás a vér -agy gáton. Ezenkívül 24 órával az adag beadása után a radioaktívan jelzett anyag koncentrációit minden más szövetben minimálisnak találták.
Biotranszformáció
A montelukaszt nagymértékben metabolizálódik. A terápiás dózisokkal végzett vizsgálatokban a montelukaszt metabolitjainak plazmakoncentrációja nem volt kimutatható egyensúlyi állapotban sem felnőtteknél, sem gyermekeknél.
Oktatás in vitro humán májmikroszómák alkalmazása azt jelzi, hogy a P450 3A4, 2A6 és 2C9 citokrómok részt vesznek a montelukaszt metabolizmusában. További megállapítások alapján in vitro az emberi máj mikroszómáin a montelukaszt terápiás plazmakoncentrációban nem gátolja a P450 3A4, 2C9, 1A2, 2A6, 2C19 vagy 2D6 citokrómokat. A metabolitok hozzájárulása a montelukaszt terápiás hatásához minimális.
Kiküszöbölés
Az egészséges felnőttnél a tisztítás a montelukaszt plazmakoncentrációja átlagosan 45 ml / perc. A radioaktív izotóppal jelzett montelukaszt dózis orális beadása után a radioaktivitás 86% -át egy ötnapos székletvizsgálattal, kevesebb mint 0,2% -át a vizeletben észlelték. Ezek az adatok, valamint a montelukaszt orális beadást követő biohasznosulására vonatkozó adatok azt jelzik, hogy a montelukaszt és metabolitjai szinte kizárólag az epével választódnak ki.
A betegek jellemzői
Idős korban vagy enyhe vagy közepesen súlyos májkárosodásban szenvedő betegeknél nincs szükség az adag módosítására. Veseelégtelenségben szenvedő betegeken nem végeztek vizsgálatokat. Mivel a montelukaszt és metabolitjai elsősorban az epe útján eliminálódnak, veseelégtelenségben szenvedő betegeknél nem várható dózismódosítás. Nincsenek farmakokinetikai adatok a montelukasztról súlyos májkárosodásban szenvedő betegeknél (Child-Pugh pontszám> 9).
Nagy montelukaszt dózisoknál (az ajánlott felnőtt adag 20-60 -szorosa) a teofillin plazmakoncentrációjának csökkenését figyelték meg, ezt a hatást nem figyelték meg a napi egyszeri 10 mg -os adag alkalmazása esetén.
05.3 A preklinikai biztonságossági adatok
Az állatokon végzett toxicitási vizsgálatok során enyhe és átmeneti szérum biokémiai változásokat figyeltek meg az SGPT (ALT), a glükóz, a foszfor és a trigliceridek szintjén. Ezek olyan dózisoknál fordultak elő, amelyek a klinikai dózisnál megfigyelt szisztémás expozíció több mint 17 -szeresét jelentették. Állatkísérletekben a montelukaszt nem befolyásolta a termékenységet és a reprodukciós képességet, ha a szisztémás expozíció több mint 24 -szer meghaladta a klinikai szisztémás expozíciót. A nőstény patkányok termékenységi vizsgálatában 200 mg / kg / nap dózisban (a klinikai expozíció) az újszülöttek súlyának enyhe csökkenését figyelték meg. Nyúlvizsgálatokban "a nem teljes csontosodás gyakoribb előfordulását figyelték meg, mint a kontrollcsoportban," szisztémás expozíció> 24 -szöröse a klinikai adagolásnál megfigyeltnek. Patkányon nem figyeltek meg rendellenességet. A montelukasztról kimutatták, hogy átjut a placenta gáton, és kiválasztódik az állatok anyatejébe.
Egerekben és patkányokban nem fordult elő elhullás egyetlen, legfeljebb 5000 mg / kg orális dózis után, amely a maximális vizsgált dózis (15 000 mg / m2 és 30 000 mg / m2 egerekben és patkányokban). Az adag a felnőtteknél javasolt humán dózis 25 000 -szeresének felel meg (egy felnőtt beteg 50 kg -os súlya alapján).
A montelukaszt egereken nem mutatott fototoxicitást az UVA-, UVB- vagy látható fényspektrumra 500 mg / kg / nap dózisig (körülbelül 200 -szorosa a klinikai adagolásnál megfigyelt szisztémás expozíciónak).
A montelukaszt in vitro és in vivo vizsgálatokban sem mutagén, sem rágcsálón nem volt onkogenikus.
06.0 GYÓGYSZERÉSZETI INFORMÁCIÓK
06.1 Segédanyagok
Mannit (E421), mikrokristályos cellulóz, kroszkarmellóz -nátrium, vörös vas -oxid (E172), hidroxipropil -cellulóz, cseresznye aroma (glicerin -triacetátot (E1518) is tartalmaz), aszpartám (E951) és magnézium -sztearát.
06.2 Inkompatibilitás
Nem releváns.
06.3 Érvényességi idő
2 év
06.4 Különleges tárolási előírások
A fénytől és nedvességtől való védelem érdekében az eredeti csomagolásban legfeljebb 25 ° C -on tárolandó.
06.5 A közvetlen csomagolás jellege és a csomagolás tartalma
Kartondoboz és PA / alumínium / PVC // 28 tablettát tartalmazó alumínium buborékcsomagolás.
06.6 Használati utasítás
Nincsenek speciális utasítások.
07.0 FORGALOMBA HOZATALI ENGEDÉLY
NEMZETKÖZI KÉMIAI INTÉZET DR. GIUSEPPE RENDE S.r.l. - Via Salaria n. 1240 - 00138 Róma
08.0 A FORGALOMBA HOZATALI ENGEDÉLY SZÁMA
AIC n. 041494016 - LÉGZÉS 4 mg rágótabletta - 28 tabletta
09.0 Az első forgalomba hozatali engedély kiadásának időpontja
Az AIFA 2013. február 12 -i határozata




















.jpg)





