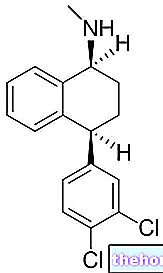
Hatóanyagok: rivasztigmin
Exelon 1,5 mg kemény kapszula
Exelon 3,0 mg kemény kapszula
Exelon 4,5 mg kemény kapszula
Exelon 6,0 mg kemény kapszula
Az Exelon csomagolóbetétek a következő csomagolási méretekhez kaphatók: - Exelon 1,5 mg kemény kapszula, Exelon 3,0 mg kemény kapszula, Exelon 4,5 mg kemény kapszula, Exelon 6,0 mg kemény kapszula
- Exelon 2 mg / ml belsőleges oldat
- Exelon 4,6 mg / 24 h transzdermális tapasz Exelon 9,5 mg / 24 h transzdermális tapasz Exelon 13,3 mg / 24 h transzdermális tapasz
Miért használják az Exelont? Mire való?
Az Exelon hatóanyaga a rivasztigmin.
A rivasztigmin a kolinészteráz -gátlóknak nevezett anyagok osztályába tartozik. Alzheimer -kórban vagy Parkinson -kórral összefüggő demenciában szenvedő betegeknél az agy bizonyos sejtjei elpusztulnak, ami alacsony acetilkolinszintet eredményez (olyan anyag, amely lehetővé teszi az idegsejtek közötti kommunikációt). A rivasztigmin úgy működik, hogy blokkolja az acetilkolint lebontó enzimeket: acetilkolinészterázt és butirilkolinészterázt. Ezen enzimek blokkolásával az Exelon növeli az acetilkolin szintjét az agyban, javítva az Alzheimer -kór tüneteit vagy a Parkinson -kórral összefüggő demenciát.
Az Exelont enyhe vagy közepes fokú Alzheimer -demenciában szenvedő felnőtt betegek kezelésére használják, a központi idegrendszer progresszív rendellenessége, amely fokozatosan befolyásolja a memóriát, a tanulást és a viselkedést. A kemény kapszulákat és az orális oldatot Parkinson -kórban szenvedő felnőtt betegek demenciájának kezelésére is használják.
Ellenjavallatok Amikor az Exelont nem szabad alkalmazni
Ne szedje az Exelont
- ha allergiás a rivasztigminre (az Exelon hatóanyaga) vagy a gyógyszer (6. pontban felsorolt) egyéb összetevőjére.
- ha bőrreakciója volt a tapasz használata során, amely túlterjedt a tapasz felhelyezésének területén, ha intenzívebb helyi reakciója volt (például hólyagok, fokozott bőrgyulladás, duzzanat), amely a következő 48 évben nem javult órát, amikor eltávolítja a tapaszt.
Ha ez vonatkozik Önre, mondja el orvosának, és ne szedje az Exelont.
Az alkalmazással kapcsolatos óvintézkedések Mit kell tudnia az Exelon szedése előtt
Az Exelon szedése előtt beszéljen kezelőorvosával:
- - ha szabálytalan szívverése van vagy volt.
- ha aktív gyomorfekélye van vagy volt valaha.
- ha vizeletürítési nehézségei vannak vagy voltak.
- ha görcsrohama van vagy volt.
- ha asztmája van vagy valaha volt, vagy súlyos légzési problémái vannak.
- ha van vagy valaha volt változása a vesefunkciójában.
- - ha májműködésének megváltozása van vagy volt valaha.
- ha remegésben szenved.
- ha kicsi a súlya.
- ha gyomor -bélrendszeri panaszokat tapasztal, mint például hányinger, hányás és hasmenés. Ha a hányás és a hasmenés továbbra is fennáll, kiszáradhat (túlzott folyadékveszteség).
Ha felismeri az egyik ilyen helyzetet, orvosa gyakrabban láthatja Önt ezzel a gyógyszeres kezelés alatt.
Ha több napig nem szedte az Exelont, konzultáljon orvosával, mielőtt folytatja a kezelést.
Alkalmazása gyermekeknél és serdülőknél
Nincs utalás az Exelon speciális alkalmazására gyermekpopulációban az Alzheimer -kór kezelésére.
Kölcsönhatások Mely gyógyszerek vagy élelmiszerek módosíthatják az Exelon hatását
Egyéb gyógyszerek és az Exelon
Feltétlenül tájékoztassa kezelőorvosát vagy gyógyszerészét a jelenleg vagy nemrégiben szedett, valamint szedni tervezett egyéb gyógyszereiről, beleértve a vény nélkül kapható készítményeket is.Az Exelont nem szabad más, hasonló hatású gyógyszerekkel együtt adni.
Az Exelon befolyásolhatja az antikolinerg gyógyszereket (gyomorgörcsök vagy görcsök enyhítésére, Parkinson -kór kezelésére vagy utazási betegség megelőzésére használt gyógyszerek).
Ha műtéten esnek át, és Exelon -kezelés alatt áll, kérjük, tájékoztassa kezelőorvosát az érzéstelenítés előtt, mivel az Exelon fokozhatja egyes izomlazítók hatását az érzéstelenítés során.
Figyelmeztetések Fontos tudni, hogy:
Terhesség, szoptatás és termékenység
Ha Ön terhes vagy szoptat, illetve ha fennáll Önnél a terhesség lehetősége vagy gyermeket szeretne, a gyógyszer alkalmazása előtt beszéljen kezelőorvosával vagy gyógyszerészével.
Ha terhes, az Exelon alkalmazásának előnyeit mérlegelni kell a születendő gyermekre gyakorolt lehetséges hatásokkal szemben.
Az Exelon -kezelés alatt nem szabad szoptatnia.
A készítmény hatásai a gépjárművezetéshez és gépek kezeléséhez szükséges képességekre
Kezelőorvosa megmondja, hogy betegsége lehetővé teszi -e a gépjárművezetést és a gépek kezelését bizonyos fokú biztonsággal. Az Exelon szédülést és álmosságot okozhat, különösen a kezelés kezdetén vagy az adag növelésekor.
Adagolás, az alkalmazás módja és ideje Az Exelon alkalmazása: Adagolás
Ezt a gyógyszert mindig a betegtájékoztatóban leírtaknak és az orvos utasításainak megfelelően szedje. Ha kétségei vannak, forduljon orvosához, gyógyszerészéhez vagy a nővérhez.
Hogyan kell elkezdeni a kezelést
Kezelőorvosa megmondja, hogy melyik Exelon adagot kell bevennie.
- A kezelés általában alacsony dózissal kezdődik.
- Kezelőorvosa lassan növeli az adagot a kezelésre adott válasz alapján.
- A legnagyobb adag, amelyet be lehet venni, naponta kétszer 6,0 mg.
Kezelőorvosa rendszeresen ellenőrizni fogja, hogy a gyógyszer működik -e.
Orvosa figyelemmel kíséri a testsúlyát is, amíg ezt a gyógyszert szedi.
Ha több napig nem szedte az Exelont, konzultáljon orvosával, mielőtt folytatja a kezelést.
A gyógyszer bevétele
- Mondja el a gondozó személynek, hogy Exelonnal kezelik.
- A kezelés előnyei érdekében minden nap vegye be a gyógyszert.
- Az Exelont naponta kétszer, reggel és este, étkezés közben vegye be.
- A kapszulákat egészben vegye be egy itallal.
- Ne nyissa fel és ne törje fel a kapszulákat.
Túladagolás Mi a teendő, ha túl sok Exelont vett be?
Ha az előírtnál több Exelont vett be
Ha véletlenül az előírtnál több Exelont vett be, közölje orvosával. Orvosi ellátásra lehet szüksége. Néhány ember, aki véletlenül túl sok Exelont vett be, hányingert, hányást, hasmenést, magas vérnyomást és hallucinációkat tapasztalt. Lassú szívverés és ájulás is előfordulhat.
Ha elfelejtette bevenni az Exelont
Ha úgy találja, hogy elfelejtette bevenni az Exelon adagját, várjon, és vegye be a következő adagot a szokásos időben.Ne vegyen be kétszeres adagot a kihagyott adag pótlására.
Ha bármilyen további kérdése van a gyógyszer alkalmazásával kapcsolatban, kérdezze meg kezelőorvosát vagy gyógyszerészét.
Mellékhatások Melyek az Exelon mellékhatásai?
Mint minden gyógyszer, így ez a gyógyszer is okozhat mellékhatásokat, amelyek azonban nem mindenkinél jelentkeznek.
A mellékhatások gyakoribbak lehetnek a gyógyszer szedésének megkezdésekor vagy az adag növelésekor. Általában a mellékhatások lassan elmúlnak, amint a szervezet megszokja a gyógyszert.
Nagyon gyakori (10 beteg közül több mint 1 beteget érinthet)
- Szédül
- Étvágytalanság
- Gyomorrontás, például hányinger, hányás, hasmenés
Gyakori (10 beteg közül legfeljebb 1 beteget érinthet)
- Szorongás
- Izzadó
- Fejfájás
- Hasfájás
- Fogyás
- Hasfájás
- Izgatott
- Fáradtság vagy gyengeség érzése
- Általános rossz közérzet
- Remegés vagy zavartság
Nem gyakori (100 beteg közül legfeljebb 1 beteget érinthet)
- Depresszió
- Alvászavarok
- Ájulás vagy véletlen elesés
- Változások a máj működésében
Ritka (1000 -ből legfeljebb 1 beteget érinthet)
- Mellkasi fájdalom
- Bőrkiütés, viszketés
- Görcsök
- Gyomor- vagy bélfekély
Nagyon ritka (10 000 -ből legfeljebb 1 beteget érinthet)
- Magas vérnyomás
- Húgyúti fertőzés
- Látni a nem létező dolgokat (hallucinációk)
- Szívritmuszavarok, például gyors vagy lassú szívverés
- Vérzés a bélből - ez a vér jelenlétében nyilvánul meg a székletben vagy a hányásban
- Hasnyálmirigy -gyulladás - súlyos fájdalom jelentkezik a felső hasban, gyakran hányinger vagy hányás kíséretében
- A Parkinson -kór jelei súlyosbodnak, vagy hasonló tünetek alakulnak ki - például izommerevség, mozgási nehézségek
Nem ismert (a gyakoriság a rendelkezésre álló adatokból nem becsülhető meg)
- Súlyos hányás, amely a száj és a gyomor (nyelőcső) összekötő traktus szakadásához vezethet
- Dehidráció (túlzott folyadékveszteség)
- Májproblémák (a bőr és a szemfehérje besárgulása, a vizelet kóros sötétedése vagy megmagyarázhatatlan hányinger, hányás, fáradtság és étvágytalanság)
- Agresszió, nyugtalanság
- Szabálytalan szívverés
Demenciában és Parkinson -kórban szenvedő betegek
Ezek a betegek gyakrabban tapasztalnak bizonyos nemkívánatos hatásokat. Néhány további mellékhatást is tapasztalnak:
Nagyon gyakori (10 beteg közül több mint 1 beteget érinthet)
- Remegés
- Ájulás
- Véletlen esések
Gyakori (10 beteg közül legfeljebb 1 beteget érinthet)
- Szorongás
- Nyugtalan érzés
- Lassú és gyors szívverés
- Alvászavarok
- Túlzott nyálképződés és kiszáradás
- Szokatlanul lassuló mozgások vagy olyan mozdulatok, amelyeket nem tud irányítani
- A Parkinson -kór jelei súlyosbodnak, vagy hasonló tünetek alakulnak ki - például izommerevség, mozgási nehézség és izomgyengeség
Nem gyakori (100 beteg közül legfeljebb 1 beteget érinthet)
- Szabálytalan szívverés és rossz mozgásszabályozás
Az Exelon transzdermális tapaszoknál észlelt egyéb mellékhatások, amelyek a kapszuláknál előfordulhatnak:
Gyakori (10 beteg közül legfeljebb 1 beteget érinthet)
- Láz
- Komoly zavartság
- Étvágytalanság
- Vizelet -inkontinencia (képtelenség megfelelően tartani a vizeletet)
Nem gyakori (100 beteg közül legfeljebb 1 beteget érinthet)
- Hiperaktivitás (magas aktivitás, nyugtalanság)
Nem ismert (a gyakoriság a rendelkezésre álló adatokból nem becsülhető meg)
- Allergiás reakciók a tapasz felhelyezésének helyén, például hólyagosodás vagy bőrgyulladás
Ha ezen tünetek bármelyike jelentkezik, forduljon orvosához, mert orvosi ellátásra lehet szüksége.
Ha Önnél bármilyen mellékhatás jelentkezik, tájékoztassa erről kezelőorvosát, gyógyszerészét vagy a gondozását végző egészségügyi szakembert, beleértve a betegtájékoztatóban fel nem sorolt bármilyen lehetséges mellékhatást is.
Lejárat és megőrzés
- A gyógyszer gyermekektől elzárva tartandó!
- A dobozon feltüntetett lejárati idő (EXP) után ne alkalmazza ezt a gyógyszert. A lejárati idő az adott hónap utolsó napjára vonatkozik.
- Legfeljebb 30 ° C -on tárolandó.
- Semmilyen gyógyszert ne dobjon a szennyvízbe vagy a háztartási hulladékba. Kérdezze meg gyógyszerészét, hogy mit tegyen a már nem használt gyógyszereivel. Ez elősegíti a környezet védelmét.
Összetétel és gyógyszerforma
Mit tartalmaz az Exelon?
- A készítmény hatóanyaga a rivasztigmin -hidrogén -tartarát.
- Egyéb összetevők: hipromellóz, magnézium -sztearát, mikrokristályos cellulóz, kicsapott szilícium -dioxid, zselatin, sárga vas -oxid (E172), vörös vas -oxid (E172), titán -dioxid (E171) és sellak.
Minden Exelon 1,5 mg kapszula 1,5 mg rivasztigmint tartalmaz.
Minden Exelon 3,0 mg kapszula 3,0 mg rivasztigmint tartalmaz.
Minden Exelon 4,5 mg kapszula 4,5 mg rivasztigmint tartalmaz.
Minden Exelon 6,0 mg kapszula 6,0 mg rivasztigmint tartalmaz.
Milyen az Exelon külleme és mit tartalmaz a csomagolás?
- Az Exelon 1,5 mg kemény kapszula, amely törtfehér vagy enyhén sárga port tartalmaz, sárga kupakkal és sárga testtel, a tetején piros "EXELON 1,5 mg" felirattal.
- Az Exelon 3,0 mg kemény kapszula, amely törtfehér vagy enyhén sárga port tartalmaz, narancssárga kupakkal és narancssárga házzal rendelkezik, a tetején piros „EXELON 3 mg” felirattal.
- Az Exelon 4,5 mg kemény kapszula, amely törtfehér vagy enyhén sárga port tartalmaz, piros kupakkal és piros testtel rendelkezik, fehér "EXELON 4,5 mg" felirattal a testén.
- Az Exelon 6,0 mg kemény kapszula, amely törtfehér vagy enyhén sárga port tartalmaz, piros kupakkal és narancssárga színű burkolattal, a tetején piros „EXELON 6 mg” felirattal.
Az Exelon kemény kapszulákat buborékcsomagolásban, három különböző kartondobozban (28, 56 vagy 112 kapszula) és 250 kapszulát tartalmazó műanyag palackokban csomagolják, de nem feltétlenül mindegyik kiszerelés kerül kereskedelmi forgalomba.
Forrás betegtájékoztató: AIFA (Olasz Gyógyszerügynökség). A tartalom 2016 januárjában jelent meg. A jelenlévő információk nem feltétlenül naprakészek.
A legfrissebb verzióhoz való hozzáféréshez ajánlatos az AIFA (Olasz Gyógyszerügynökség) webhelyét elérni. Jogi nyilatkozat és hasznos információk.
01.0 A GYÓGYSZER MEGNEVEZÉSE
EXELON 3.0 MG
02.0 MINŐSÉGI ÉS MENNYISÉGI ÖSSZETÉTEL
Minden kapszula rivasztigmin -hidrogén -tartarátot tartalmaz, ami 3,0 mg rivasztigminnek felel meg.
A segédanyagok teljes listáját lásd a 6.1 pontban.
03.0 GYÓGYSZERFORMA
Kemény kapszula.
Csaknem fehér vagy halványsárga por kapszulában, narancssárga testtel és narancssárga kupakkal, piros "EXELON 3 mg" felirattal a testén.
04.0 KLINIKAI INFORMÁCIÓK
04.1 Terápiás javallatok
Enyhe és közepesen súlyos Alzheimer -típusú demencia tüneti kezelése.
Enyhe vagy közepesen súlyos demencia tüneti kezelése idiopátiás Parkinson -kórban szenvedő betegeknél.
04.2 Adagolás és alkalmazás
A kezelést az Alzheimer -kór vagy a Parkinson -kórhoz kapcsolódó demencia diagnosztizálásában és kezelésében jártas orvosnak kell megkezdenie és felügyelnie. A diagnózist a jelenlegi irányelvek szerint kell elvégezni. A rivasztigmin -kezelést csak akkor szabad elkezdeni, ha rendelkezésre áll egy „gondozó” (aki általában törődik a beteggel), aki rendszeresen ellenőrizni tudja a beteg gyógyszerbevitelét.
A rivastigmine -t naponta kétszer, reggelivel és vacsorával adják be. A kapszulákat egészben kell lenyelni.
Kezdő adag
1,5 mg naponta kétszer.
Az adag titrálása:
A kezdő adag 1,5 mg naponta kétszer. Ha ezt az adagot legalább kéthetes kezelés alatt jól tolerálják, akkor azt naponta kétszer 3 mg -ra lehet emelni. A későbbi, 4,5 -re, majd napi kétszer 6 mg -ra történő emelésnek mindig a beadandó adag legalább két hétig tartó jó tolerálhatóságán kell alapulnia.
Ha a kezelés során mellékhatások (pl. Hányinger, hányás, hasi fájdalom, étvágytalanság), testsúlycsökkenés vagy az extrapiramidális tünetek (pl. Remegés) súlyosbodása jelentkezik Parkinson -kórral összefüggő demenciában szenvedő betegeknél, ezek reagálhatnak egy vagy több adag elhagyására Ha a mellékhatások továbbra is fennállnak, a napi adagot átmenetileg csökkenteni kell a korábbi jól tolerált adagra, vagy a kezelést meg kell szakítani.
Fenntartó adag:
A hatékony dózis 3-6 mg naponta kétszer; A maximális terápiás előny elérése érdekében a betegeket a legmagasabb jól tolerált dózisban kell tartani. A maximális ajánlott adag 6 mg naponta kétszer.
A fenntartó kezelés mindaddig folytatható, amíg a terápiás előny látható. Ezért a rivasztigmin klinikai előnyét rendszeresen felül kell vizsgálni, különösen azoknál a betegeknél, akiket naponta kétszer 3 mg -nál kisebb dózissal kezelnek. Ha 3 hónapos kezelés után. a demencia tüneteit nem befolyásolja pozitívan, a kezelést abba kell hagyni, még akkor is, ha nem találnak terápiás hatást, meg kell fontolni a kezelés abbahagyását. A rivasztigminre adott egyéni válasz kiszámíthatatlan. Mindazonáltal nagyobb terápiás hatást észleltek Parkinson -kórban szenvedő, mérsékelt demenciában szenvedő betegeknél. Hasonlóan nagyobb hatást figyeltek meg vizuális hallucinációkkal rendelkező Parkinson -kórban szenvedő betegeknél (lásd 5.1 pont).
A terápiás hatást 6 hónapnál hosszabb ideig tartó placebo-kontrollos klinikai vizsgálatokban nem vizsgálták.
A terápia újbóli bevezetése:
Ha a kezelést több napra megszakítják, a kezelést naponta kétszer 1,5 mg -mal kell kezdeni. Ezt követően a dózistitrálást a fent leírtak szerint kell elvégezni.
Vese- és májelégtelenség:
A gyógyszer fokozott expozíciója miatt, közepes fokú veseelégtelenség vagy enyhe vagy mérsékelt májkárosodás esetén az adagolást óvatosan, az egyéni tolerancia szerint kell titrálni (lásd 5.2 pont).
Súlyos májkárosodásban szenvedő betegeket nem vizsgáltak (lásd 4.3 pont).
Alkalmazása gyermekeknél:
A rivasztigmin alkalmazása gyermekeknél nem ajánlott.
04.3 Ellenjavallatok
A gyógyszer alkalmazása ellenjavallt olyan betegeknél, akik:
túlérzékenység a hatóanyaggal, más karbamát -származékokkal vagy a készítményben használt bármely segédanyaggal szemben;
súlyos májkárosodás, mivel a gyógyszert ebben a populációban nem vizsgálták.
04.4 Különleges figyelmeztetések és a használathoz szükséges óvintézkedések
A mellékhatások gyakorisága és súlyossága általában magasabb dózisokkal nő. Ha a kezelést több napra megszakítják, a kezelést naponta kétszer 1,5 mg -mal kell folytatni a mellékhatások kockázatának csökkentése érdekében (pl.
Adagolás titrálása: A mellékhatásokat (pl. Magas vérnyomás és hallucinációk Alzheimer -demenciában szenvedő betegeknél és az extrapiramidális tünetek súlyosbodását, különösen remegést, Parkinson -kórral járó demenciában szenvedő betegeknél) közvetlenül az adag növelése után észlelték. Érzékenyek lehetnek az adag csökkentésére. esetekben az Exelon beadását megszakították (lásd 4.8 pont). Emésztőrendszeri betegségek, például hányinger és hányás, ezek különösen a kezelés kezdetén és / vagy az adag növelésekor jelentkezhetnek. Ezek a mellékhatások gyakrabban fordulnak elő nőknél. Az Alzheimer -kórban szenvedő betegek hajlamosak a fogyásra. A kolinészteráz inhibitorok, beleértve a rivasztigmin alkalmazását is ezeknél a betegeknél. A kezelés alatt ellenőrizni kell a betegek testtömegét.
Ha súlyos hányás lép fel a rivasztigmin -kezeléssel összefüggésben, akkor a dózist megfelelően módosítani kell a 4.2 pontban leírtak szerint. A súlyos hányás egyes epizódjaihoz nyelőcsőrepedés társult (lásd 4.8 pont). Ezek az epizódok különösen a rivasztigmin dózisának növelése vagy nagy dózisok alkalmazása után fordultak elő.
Óvatosan kell eljárni, ha rivasztigminet adnak betegeknek, akik szinuszos szindrómában vagy vezetési zavarokban szenvednek (szinoptriás blokk, atriokamrai blokk) (lásd 4.8 pont).
A rivasztigmin fokozott gyomorsav -elválasztást okozhat. Különös óvatosság ajánlott aktív gyomor- vagy nyombélfekélyben szenvedő betegek, illetve hajlamos betegek kezelésére.
A kolinészteráz inhibitorokat óvatosan kell felírni azoknak a betegeknek, akiknek kórtörténetében asztma vagy obstruktív tüdőbetegség áll fenn.
A kolinomimetikumok húgyúti akadályokat és görcsöket okozhatnak vagy súlyosbíthatnak. Óvatosság ajánlott az ilyen típusú betegségekre hajlamos betegek kezelésekor. A rivasztigmin alkalmazását súlyos Alzheimer-demenciában vagy Parkinson-kórral járó demenciában, más típusú demenciában vagy más típusú memóriazavarokban (pl. Korhoz kapcsolódó kognitív hanyatlás) szenvedő betegeknél nem vizsgálták. nem ajánlott.
A többi kolinomimetikumhoz hasonlóan a rivasztigmin súlyosbíthatja vagy kiválthatja az extrapiramidális tüneteket. A Parkinson -kórhoz társuló demenciában szenvedő betegeknél súlyosbodást (beleértve a bradykinéziát, diszkinéziát, kóros járást) és „a remegés gyakoriságának vagy súlyosságának növekedését figyelték meg (lásd 4.8 pont). Ezek az események bizonyos esetekben a kezelés abbahagyásához vezethetnek. (pl. a remegés okozta abbahagyás a rivasztigmin -kezelésben részesülő betegek 1,7% -ánál, míg a placebo -csoport 0% -a). Ezen mellékhatások klinikai megfigyelése javasolt.
04.5 Kölcsönhatások más gyógyszerekkel és más interakciók
Mivel a kolinészteráz inhibitor, a rivasztigmin fokozhatja a szukcinilkolin típusú izomrelaxánsok hatását az érzéstelenítés során. Óvatosság ajánlott az érzéstelenítők kiválasztásakor. Szükség esetén megfontolandó az adag módosítása vagy a kezelés ideiglenes abbahagyása.
Farmakodinámiás hatása miatt a rivasztigmin nem adható más kolinomimetikus anyagokkal együtt; Ez befolyásolhatja az antikolinerg gyógyszerek hatását. Egészséges önkénteseken végzett vizsgálatok során nem figyeltek meg farmakokinetikai kölcsönhatást a rivasztigmin és a digoxin, a warfarin, a diazepám vagy a fluoxetin között. Digoxin és rivasztigmin egyidejű alkalmazásakor nem észleltek nemkívánatos hatásokat a szívvezetésre. Az anyagcseréje alapján a gyógyszerrel való kölcsönhatás más gyógyszerekkel valószínűtlennek tűnik, bár a rivasztigmin gátolhatja más anyagok butiril-kolinészteráz által közvetített metabolizmusát.
04.6 Terhesség és szoptatás
A rivasztigmin terhességre vonatkozó klinikai adatai nem állnak rendelkezésre. Patkányokban és nyulakban nem figyeltek meg termékenységi vagy embrió-magzati fejlődésre gyakorolt hatást, kivéve azokat az adagokat, amelyeknél anyai toxicitás lépett fel. Patkányokon végzett posztnatális vizsgálatokban a terhességi idő növekedését figyelték meg. A rivasztigmin terhesség alatt nem alkalmazható, kivéve, ha egyértelműen szükséges.
Állatokban a rivasztigmin kiválasztódik az anyatejbe. Nem ismert, hogy a rivasztigmin kiválasztódik -e az anyatejbe, ezért a rivasztigminnel kezelt nők nem szoptathatnak.
04.7 Hatások a gépjárművezetéshez és gépek kezeléséhez szükséges képességekre
Az Alzheimer -kór a gépjárművezetéshez és a gépek kezeléséhez szükséges képességek fokozatos elvesztését okozhatja. A rivasztigmin szédülést és aluszékonyságot is kiválthat, különösen a kezelés kezdetén vagy az adag emelésekor. A rivasztigmin enyhe vagy mérsékelt hatást fejt ki a gépjárművezetéshez és gépek kezeléséhez szükséges képességekre, ezért a kezelőorvosnak rendszeresen értékelnie kell a rivasztigmin -kezelésben részesülő demenciában szenvedő betegek azon képességét, hogy folytassák a gépjárművezetést vagy a bonyolult gépek kezelését.
04.8 Nemkívánatos hatások
A leggyakrabban jelentett mellékhatások gasztrointesztinális jellegűek, és közéjük tartozik a hányinger (38%) és a hányás (23%), különösen a titrálási szakaszban. A klinikai vizsgálatok során a nőknél a férfiaknál érzékenyebbnek találták a gyomor -bélrendszeri reakciókat és a fogyást. Az 1. táblázatban felsorolt mellékhatások az Alzheimer -kórban szenvedő, Exelonnal kezelt betegekre vonatkoznak.
A mellékhatásokat az 1. táblázat MedDRA szervrendszerek és gyakorisági osztályok szerint sorolja fel. A gyakorisági osztályokat a következő hagyományos paraméterek alapján határozzák meg: nagyon gyakori (≥1 / 10), gyakori (≥1 / 100;
Asztal 1
Az Exelon transzdermális tapaszoknál a következő mellékhatásokat figyelték meg: szorongás, delírium, láz (gyakori).
A 2. táblázat az Exelon -nal kezelt Parkinson -kórral összefüggő demenciában szenvedő betegeknél jelentett mellékhatásokat mutatja be.
2. táblázat
A 3. táblázat felsorolja azon betegek számát és százalékos arányát, akik részt vettek egy 24 hetes, Exelon-nal kezelt Parkinson-kórral összefüggő demenciában szenvedő betegekben végzett klinikai vizsgálatban, amelyben előre meghatározott mellékhatások fordultak elő, amelyek a parkinson-kór tüneteinek súlyosbodását tükrözik.
3. táblázat
04.9 Túladagolás
Tünetek:
A véletlen túladagolás legtöbb esetben tünetmentes volt, és szinte minden érintett beteg folytatta a rivasztigmin -kezelést. Tüneti túladagolás esetén a következőket figyelték meg: hányinger, hányás, hasmenés, magas vérnyomás vagy hallucinációk. A kolinészteráz inhibitorok pulzusszámra gyakorolt ismert vagotóniás hatása miatt bradycardia és / vagy ájulás léphet fel. Egy esetben 46 mg lenyelés történt; konzervatív kezelés után a beteg 24 óra alatt teljesen felépült.
Kezelés:
Mivel a rivasztigmin plazma felezési ideje körülbelül 1 óra, és az acetil-kolinészteráz-gátlás időtartama körülbelül 9 óra, tünetmentes túladagolás esetén nem javasolt további rivasztigmin-adagok alkalmazása a következő 24 órában. Súlyos hányingerrel és hányással járó túladagolás esetén mérlegelni kell az antiemetikumok alkalmazását. Egyéb tünetek esetén megfelelő tüneti kezelést kell biztosítani. Súlyos túladagolás esetén az atropin alkalmazható. Az atropin alkalmazása ajánlott a kezdeti dózis 0,03 mg / kg intravénásan az atropin -szulfát, az ezt követő dózismódosítással a klinikai válasznak megfelelően.
05.0 FARMAKOLÓGIAI TULAJDONSÁGOK
05.1 Farmakodinámiás tulajdonságok
Farmakoterápiás csoport: antikolinészterázok, ATC -kód: N06DA03.
A rivasztigmin egy karbamid típusú acetil- és butiril-kolinészteráz inhibitor, amely megkönnyíti a kolinerg neurotranszmissziót azáltal, hogy lelassítja a funkcionálisan ép kolinerg neuronok által felszabaduló acetilkolin inaktiválódását. A rivasztigmin ezért javíthatja a kolinerg mediált kognitív hiányosságokat az Alzheimer -kórhoz és a Parkinson -kórhoz kapcsolódó demenciában.
A rivasztigmin kölcsönhatásba lép a cél enzimjeivel, és kovalensen kötött komplexet képez, amely ideiglenesen inaktiválja az enzimeket. Egészséges fiatal önkénteseknél a szájon át adott 3 mg -os adag körülbelül 40% -kal csökkenti az acetil -kolinészteráz (AChE) aktivitását a cerebrospinális folyadékban a beadás utáni első másfél órában. Az enzim aktivitása körülbelül 9 órával a maximális gátló hatás elérése után visszatér a kiindulási szintre. Alzheimer-kórban szenvedő betegeknél a rivasztigmin AChE gátlása a cerebrospinális folyadékban dózisfüggő volt. Napi kétszer 6 mg-ig A rivasztigminnel kezelt 14 Alzheimer -kórban szenvedő betegnél a butiril -kolinészteráz -aktivitás gátlása a cerebrospinális folyadékban hasonló volt az agyban észlelthez.
Klinikai vizsgálatok az Alzheimer -féle demenciában:
A rivasztigmin hatékonyságát három független és tartományspecifikus értékelési eszközzel értékelték, amelyeket rendszeres időközönként ellenőriztek a 6 hónapos kezelési időszak alatt. Ezek az eszközök az ADAS-Cog (a kognitív kapacitás felmérése), a CIBIC-Plus (a páciens általános értékelése az orvos által, figyelembe véve a "gondozó" által közölteket) és a PDS (a a szokásos napi tevékenységek "gondozója", mint például a személyes higiénia, az étkezési, öltözködési, házimunka, vásárlási képesség, a környező környezetben való tájékozódási képesség fenntartása, valamint a pénzkezeléssel kapcsolatos tevékenységekben való részvétel stb.) . A vizsgált betegek Mini-Mental State Examination (MMSE) pontszáma 10 és 24 között volt. A klinikailag szignifikáns válaszreakciójú betegek eredményei a rugalmas dózisú vizsgálatok közül kettő kombinált elemzéséből derültek ki. Enyhe vagy közepesen súlyos Alzheimer-típusú demenciában szenvedő betegeknél végzett 26 hetes vizsgálatot az alábbi 4. táblázat tartalmazza. Ezekben a vizsgálatokban a klinikailag releváns javulást a priori az ADAS-Cog legalább 4 pontos javulásának tekintették, ami a CIBIC-Plus vagy a PDS legalább 10% -os javulása.
Ugyanebben a táblázatban a válasz utólagos meghatározása is megtalálható. A válasz másodlagos meghatározása 4 pontos vagy annál nagyobb javulást igényelt az ADAS-Cog-ban, a CIBIC-Plus és a PDS romlása nélkül. A 6-12 mg-os csoportban a válaszadók átlagos dózisa ennek a definíciónak megfelelően 9,3 mg volt. Fontos megjegyezni, hogy az ebben a javallatban használt skálák eltérőek, és a különböző terápiás szerek eredményeinek közvetlen összehasonlítása nem érvényes.
4. táblázat
* p
A Parkinson -kórhoz kapcsolódó demencia klinikai vizsgálatai:
A rivasztigmin hatékonyságát a Parkinson-kórral összefüggő demenciában egy 24 hetes, többközpontú, placebo-kontrollos vizsgálat kettős vak fázisában és 24 hetes nyílt meghosszabbításával igazolták. A vizsgálatba bevont betegek. (Mini-Mental State Examination) pontszám 10 és 24 között. A hatékonyság értékelését két független skála használatával végeztük el, amelyeket rendszeres időközönként értékeltünk a 6 hónapos kezelési időszak alatt, az alábbi 5. táblázat szerint: ADAS-Cog (a kognitív képességek értékelési skálája) és az ADCS-CGIC általános értékelése (az orvos által a betegre vonatkozó globális értékelés skála).
5. táblázat
1 Az ANCOVA alapján, a kezelés és az ország tényezőként, valamint az ADASCog kiindulási értékelése, mint kovariáns. A pozitív változás javulást jelez.
2 Átlagos értékek a kényelem érdekében, kategóriaelemzés van Elteren ITT teszttel: Intent-To-Treat; RDO: Retrieved Drop Outs; LOCF: Utolsó megfigyelés
Bár a kezelés hatását a teljes vizsgált populációban kimutatták, az adatok azt sugallják, hogy a placebóhoz képest nagyobb hatást figyeltek meg a Parkinson -kórhoz társuló mérsékelt demenciában szenvedő betegek alcsoportjában. lásd a 6. táblázatot).
6. táblázat
1 Az ANCOVA alapján, a kezelés és az ország tényezőként, valamint az ADASCog kiindulási értékelése, mint kovariáns. A pozitív változás javulást jelez.
ITT: Kezelési szándék: RDO: Retrieved Drop Outs
05.2 Farmakokinetikai tulajdonságok
Abszorpció:
A rivasztigmin gyorsan és teljesen felszívódik. A plazma csúcskoncentráció körülbelül 1 órán belül érhető el. A rivasztigmin és a cél -enzim közötti kölcsönhatás következtében a biológiai hozzáférhetőség növekedése körülbelül 1,5 -szer nagyobb, mint az adag növelésével várható. 3 mg -os dózis esetén az abszolút biohasznosulás 36% ± megközelítőleg 13%. elnyelés (tmax) 90 "-kal, csökkenti a Cmax -értékeket és körülbelül 30%-kal növeli az AUC -t.
terjesztés:
A rivasztigmin körülbelül 40% -a kötődik a plazmafehérjékhez. Gyorsan átjut a vér -agy gáton, és látszólagos eloszlási térfogata 1,8 és 2,7 l / kg között van.
Anyagcsere:
A rivasztigmin gyorsan és nagymértékben metabolizálódik (plazma felezési ideje körülbelül 1 óra) dekarbamilezett metabolitmá, elsősorban kolinészteráz hidrolízissel. In vitro ez a metabolit elhanyagolható gátló hatást fejt ki az acetil -kolinészterázra (a citokróm P450 elhanyagolhatóan részt vesz a rivasztigmin metabolizmusában. 0,2 mg intravénás beadás után a rivasztigmin teljes plazma clearance -e körülbelül 130 l / óra, és 70 l / óra alatt csökken. 2,7 mg intravénás beadás után.
Kiválasztás:
Változatlan rivasztigmin nem található a vizeletben; a metabolitok renális kiválasztása a fő eliminációs út. A 14C-rivasztigmin beadását követően a vesén keresztül történő elimináció gyors és gyakorlatilag teljes (> 90%) 24 órán belül megtörtént.A beadott adag kevesebb mint 1% -a ürül a széklettel. Az Alzheimer -kórban szenvedő betegeknél a rivasztigmin vagy a dekarbamilezett metabolit nem halmozódik fel.
Idős alanyok:
Bár a rivasztigmin biohasznosulása magasabb idős személyeknél, mint fiatal egészséges önkénteseknél, az Alzheimer -kórban szenvedő, 50–92 éves betegekben végzett vizsgálatok nem számoltak be a biológiai hozzáférhetőség változásáról az életkor előrehaladtával.
Károsodott májfunkciójú betegek:
A rivasztigmin Cmax- és AUC-értékei körülbelül 60%, illetve több mint kétszer magasabbak enyhe vagy közepesen súlyos májkárosodásban szenvedő betegeknél, mint egészségeseknél.
Veseelégtelenségben szenvedő betegek:
A rivasztigmin Cmax és AUC értékei több mint kétszer olyan magasak a mérsékelt vesekárosodásban szenvedő betegeknél, mint az egészségesek; azonban a rivasztigmin Cmax és AUC értékei súlyos vesekárosodásban szenvedőknél nem változnak.
05.3 A preklinikai biztonságossági adatok
Patkányokon, egereken, kutyákon végzett ismételt dózisú toxicitási vizsgálatok csak "túlzott farmakológiai hatásnak" tulajdonítható hatásokat mutattak ki. A célszervekre nem figyeltek meg toxicitást. Az alkalmazott állatmodellek érzékenysége miatt nem értek el határértékeket. Biztonság kitettség.
A rivasztigminről kimutatták, hogy nem tartalmaz mutagén hatást a standard tesztek során in vitro És in vivo, kivéve a humán perifériás limfocitákban végzett kromoszóma -rendellenesség -vizsgálatot a klinikán beadott maximális dózis 104 -szeresénél. A mikronukleusz teszt in vivo negatív lett tesztelve. A legnagyobb tolerált dózisú egereken, patkányokon végzett vizsgálatokban nem volt bizonyíték a rákkeltő hatásra, bár a rivasztigmin és metabolitjai expozíciója alacsonyabb volt, mint az emberi expozíció. A testfelülethez képest a rivasztigmin és metabolitjai expozíciója megközelítőleg egyenértékű volt a maximális ajánlott napi 12 mg humán dózisig; azonban a maximális humán dózishoz képest állatokban megközelítőleg hatszoros többszörös értéket értek el.
Állatokban a rivasztigmin átjut a placentán, és kiválasztódik az anyatejbe. Terhes patkányokon és nyulakon végzett orális vizsgálatok nem szolgáltattak információt a rivasztigmin teratogén potenciáljáról.
06.0 GYÓGYSZERÉSZETI INFORMÁCIÓK
06.1 Segédanyagok
Zselatin, magnézium -sztearát, hipromellóz, mikrokristályos cellulóz, kicsapott szilícium -dioxid, sárga vas -oxid (E172), vörös vas -oxid (E172), titán -dioxid (E171).
06.2 Inkompatibilitás
Nem releváns.
06.3 Érvényességi idő
5 év
06.4 Különleges tárolási előírások
Legfeljebb 30 ° C -on tárolandó.
06.5 A közvetlen csomagolás jellege és a csomag tartalma
Buborékcsomagolás, átlátszó PVC tálcából, kék fedőlappal, 14 kapszulát tartalmaz. Minden doboz 2, 4 vagy 8 buborékfóliát tartalmaz.
Nagy sűrűségű polietilén palack műanyag záróval és belső indukciós tömítéssel.
Minden palack 250 kapszulát tartalmaz.
Nem feltétlenül mindegyik kiszerelés kerül kereskedelmi forgalomba.
06.6 Használati utasítás
Nincsenek speciális utasítások.
07.0 FORGALOMBA HOZATALI ENGEDÉLY
Novartis Europharm Limited
Wimblehurst út
Horsham
Nyugat -Sussex, RH12 5AB
Egyesült Királyság
08.0 A FORGALOMBA HOZATALI ENGEDÉLY SZÁMA
EU / 1/98/066 / 004-6
EU/1/98/066/015
09.0 Az első forgalomba hozatali engedély kiadásának időpontja
Az első engedély kiadásának dátuma: 1998.05.12
Az utolsó megújítás dátuma: 2008.05.12